Перспективы развития санаторно-курортного лечения с внедрением новых технологий
В.В. Корольков, С.В. Туранина
Санаторий «Сунгуль» Челябинской обл.
2009 год
Санаторно-курортное лечение - вид лечебно-профилактической помощи населению, основанный на преимущественном использовании природных лечебных факторов (климат, минеральные воды, морские купания, лечебные грязи и т. д.), которое проводится с учётом новейших достижений клинической, восстановительной и курортной медицины, фармакологии, медицинской физики и других смежных дисциплин.
Научно обоснованное расширение и уточнение показаний для направления больных на лечение в санаторно-курортных условиях, позволило успешно проводить терапию пациентам, ранее лишённых такой возможности.
Учитывая полиморбидность современной патологии, особенно у лиц геронтологической группы и детей, лечение в санаторно-курортных условиях должно быть многопрофильным, с применением как традиционных, так и нетрадиционных методов терапии. Очень важным условием является возможность максимального снижения числа нежелательных реакций, в т.ч. аллергического и токсического характера, нередко сопровождающих лечение.
Для снижения количества осложнений можно пойти несколькими путями. Один из них - снижение дозы препаратов с сохранением лечебного эффекта. Другой путь: введение препаратов, минуя желудочно-кишечный тракт. Наиболее простой способ - чрескожный. Это аппликационное воздействие (мази, кремы, гели, лечебные грязи и др.). Есть много других способов, в т.ч. с регулируемой подачей лекарственных средств (ЛС). Для этого используют ряд подходов. Например, ковалентное и нековалентное связывание молекул Л С с водорастворимыми полимерами [18; 24]; создание, так называемых, макромолекулярных терапевтических систем (МТС, ТТС). Они являются своеобразной лекарственной формой, в которой ЛС растворено или диспергировано в массе полимера. МТС и ТТС, помимо ряда преимуществ перед другими лекарственными формами, могло бы получить большое распространение из-за их экономичности, т.к. целенаправленное использование ЛС позволяет снизить его концентрацию в десятки раз при сохранении терапевтического эффекта [16, 30, 38]. Их применение должно удешевить лечение и сделать более доступными уникальные дорогостоящие препараты.
Принцип действия ТТС заключается в том, что за счёт концентрации лекарственные вещества диффундируют из резервуара (матрицы) и проникают в организм, благодаря пассивной диффузии через кожу.
Трансдермальная доставка лекарств имеет несколько преимуществ: поддержание постоянной концентрации лекарственного вещества в крови на определенном уровне в течение длительного времени; возможность защиты лекарственных веществ от разрушения в желудочно-кишечном тракте; отсутствие раздражающего действия лекарств на желудочно-кишечный тракт; удобство для больных за счёт снижения частоты приемов лекарств и возможности самостоятельного нанесения ТТС, при этом уменьшаются трудозатраты медицинского персонала, введения препарата в организм безболезненно и удобно, особенно пациентам детского и пожилого возраста; была отмечена хорошая совместимость ТТС с некоторыми физическими факторами, послужившая предпосылкой к разработке трансдермаль- ных физиотерапевтических систем (ТФС).
ТТС делят на две группы: матричные и мембранные (резервуарные). В матричных ТТС лекарственное вещество растворено или диссоциировано во всем объеме полимерного тела, т. е. помещается в матрицу, состоящую из геля или полимерной пленки. Высвобождение лекарств из такой системы определяется его диффузией из материала матрицы. Мембранные ТТС (или равиоли) состоят из непроницаемой подложки, резервуара с лекарственным веществом, мембраны, регулирующей высвобождение лекарственного средства и адгезивного слоя, т. е. лекарственное вещество в Виде суспензии, жидкости или геле находится в резервуаре, покрытом полимерной мембраной (рис. 1-2). Резервуар располагается между непроницаемой подложкой и мембраной из пористой полимерной фольги, определяющей скорость высвобождения лекарственного вещества. Известны и Другие классификации ТТС [14, 33].

Рис. 1. Схема конструкции матричной ТТС
1 - герметичная подкладка, 2- адгезивный матричный резервуар, содержащий препарат
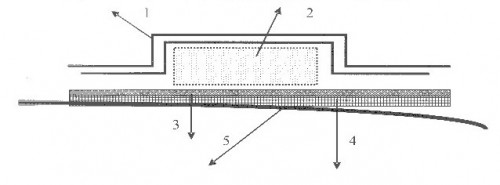
Рис. 2. Схема мембраноконтролируемой резервуарной ТТС (Ravioli-тип)
1 - покровная плёнка, 2 - резервуар с лекарством, 3 - мембрана, 4 - адгезивный слой, 5-защитная антиадгезивная пленка
Доставка лекарств через кожу подчинена существенным взаимосвязям, которые ограничивают общее применение этой технологии. Сегодня исследуется много подходов, чтобы преодолеть барьерные свойства кожи и улучшить возможности применения ТТС. Чтобы достичь нового уровня, необходимо разработать технологии, посредством которых проницаемость лекарственного средства могла бы стать обратимой, предсказуемой и контролируемой.
На сегодняшний день исследования по совершенствованию технологии ТТС проводятся по трем направлениям: биохимическому, физическому и химическому.
Биохимическое усовершенствование подразумевает кратковременное физико-химическое изменение лекарства, облегчающее его проникновение через кожу. Измененная молекула лекарства, получившая название «пролекарства», терапевтически неактивна. После проникновения в роговой слой она подвергается гидролитическому или ферментативному изменению и превращается в исходное лекарственное вещество или его активное производное. Такой подход апробирован на самых различных лекарствах, но до широкого коммерческого использования дело пока не дошло. В равной мере это относится и к доставке лекарств с помощью липидных везикул, способных проникать сквозь кожу, самостоятельно депонироваться в роговом слое и там же начинать действовать по принципу систем с контролируемым высвобождением. Большие перспективы сулит использование для этих целей различных типов наначастиц.
Физическое усовершенствование ТТС предполагает использование внешних физических факторов для улучшения проницаемости кожи и изменения фармакокинетики лекарств, входящих в их состав.
Химическое усовершенствование ТТС сводится к использованию внешних химических субстанций для улучшения проникновения лекарственных веществ через кожный барьер путем нарушения упорядоченной структуры межклеточного жирового слоя stratum corneum [12]. Такая модификация приводит к улучшению текучести этого слоя и растворимости лекарственного вещества в поверхностных слоях кожи. По способности увеличивать скорость проникновения молекул лекарственного вещества через кожу изученные химические соединения располагаются следующим образом: от многоатомных спиртов до жирных кислот и от сложных эфиров жирных кислот к терпенам [1, 8]. Неплохими пенетрирующими свойствами обладают и некоторые поверхностно-активные вещества (твины, сланы), а также глицерин.
В процессе курортного лечения под влиянием любого природного фактора у больных, особенно с заболеваниями воспалительного и дистрофического характера, развиваются сложные процессы, играющие значимую роль в процессе выздоровления (реабилитации).
С целью оптимизации лечебного процесса, повышения эффективности проводимой терапии, снижения количества осложнений и бальнеологических реакций, а также экономии денежных ресурсов, врачи и учёные все чаще обращаются к комбинированным методам грязелечения - с одновременным воздействием пелоидотерапии и процедур с преформированным фактором. Сочетанное воздействие придает лечебному фактору новое качество, когда данную процедуру можно назначать лицам, имеющим противопоказания к применению процедур общего воздействия или надо воздействовать на небольшие участки тела больного. Сочетанное воздействие нередко оказывается более эффективным и щадящим по сравнению с энергичной монотерапией.
Сведения о модуляции скорости поступления лекарственных препаратов в организм под действием физических методов (электрофорез, фонофорез, магнито- и лазеротерапия и т.д.) позволяют сделать вывод об использовании ТТС с целью усиления эпителиальной проницаемости, ускорения микроциркуляции в кожных покровах, повышения температуры в области приложения физиотерапевтических процедур [2,15,23,27,28,31].
Из лечебных физических факторов в аспекте рассматриваемой проблемы наибольший интерес представляют ультразвук и постоянный ток. Из доступных литературных данных следует, что ультразвук вызывает разрыхление эпидермиса и соединительнотканных слоев кожи, увеличивает количество активных желез кожи, что является морфофункциональной основой повышения проницаемости кожных покровов для лекарственных средств [3, 28, 29, 36]. Бусаров С.Г. в экспериментах на животных с использованием меченых атомов показал, что ультразвук существенно повышает чрескожное прохождение лекарств через кожу [3]. Результаты ряда исследований косвенно указывают на повышение проницаемости кожи под влиянием магнитных полей разных параметров и электрического тока [15, 32]. То же самое можно сказать о лазерном излучении. Имеются данные, косвенно указывающие на повышение проницаемости кожи для лекарственных веществ после ее облучения красным и инфракрасным лазером [19, 31], лишь в единичных работах имеются прямые доказательства повышения кожной проницаемости для некоторых лекарств (аскорбиновая кислота, анальгетики, нальбуфин и др.) под действием лазерного излучения [19, 36, 37].
Согласно сравнительным исследованиям R. Lotmar, по степени повышения проницаемости кожи для лекарств, исследованные им факторы расположил в следующем порядке: гальванизация (увеличение на 95 %), облучение лампой соллюкс (37 %), облучение ультрафиолетовыми лучами (24 %), ультразвуковое воздействие (17 %).
Отсюда следует, что физические факторы существенно влияют на проникновение в организм лекарственных веществ при аппликации на кожу. В большинстве случаев, особенно при сочетанном воздействии или сразу после применения физических факторов, наблюдается заметное повышение проницаемости кожи для лекарственных средств.
Анализируя настоящие данные, можно сделать вывод, что одним из важнейших путей повышения терапевтической эффективности ТТС может явиться создание грансдермальных физиотерапевтических транспортных систем (ТФТС или ТФС), где в качестве комбинированной терапии перспективно использовать электрические токи, ультразвук, магнитные поля и т.д.
Следовательно, согласно многочисленным данным, ТТС представляют собой удобную и эффективную лекарственную форму управляемой доставки в организм лекарств, в особенности длительного применения. Достоинством этой лекарственной формы являются легкость применения, возможность длительной, безболезненной и непрерывной подачи лекарств с заданной скоростью без медицинского персонала, в том числе на производстве, в экстремальных и домашних условиях. Еще большие преимущества сулит применение ТФС. Использование их не только обеспечивает ускорение поступления лекарств в организм и доставку в орган-мишень, но и повышает их фармакологическую активность, позволяет оказывать воздействие на организм тем или иным физическим фактором. Разработка и применение ТФС сдерживаются особыми требованиями, которым должны отвечать включаемые в них лекарственные вещества, а также определенными техническими трудностями. Несмотря на это, ТФС в сочетании с постоянным электрическим током в ряде стран уже находит практическое применение. Использование других лечебных факторов с ТФС пока не применяется и требует проведения углубленных научных исследований. Последние должны быть, по нашему мнению, направлены на решение следующих задач:
- поиск пригодных для использования в ТФС лекарственных средств;
- активное изучение фармакокинетики и фармакодинамики лекарств, используемых в ТФС в сочетании с различными физическими факторами;
- дальнейший поиск и разработка современных конструкций ТФС и их сравнительная оценка;
- медико-экономическая оценка ТФС при различных заболеваниях и состояниях.
К сожалению, ТТС чаще всего создают на основе одного ЛС [7; 13; 23; 33], и они до настоящего времени не нашли широкого применения в клинической практике.
Сегодня достаточно перспективным и распространённым является применение в лечебной практике многокомпонентных мазей (МКМЭ) и эфтипелоидов. Так, их применение позволяет сократить число болезненных хирургических и терапевтических манипуляций, оказывает щадящее действие на психику больного,увеличивает эффективность лечения при меньших затратах, ускоряет заживление ожогов, ран, язв и т.д. [5; б; 21].
Применение МКМЭ в клинической практике началось с 1993 г., а применение эфтипелоидов в санаторно- курортных условиях Уральского региона - с 2006 г., и в основном, направлено на проведение поисковых и диссертационных работ, подготовку документации для сертификации и лицензирования производства.
Эфтипелоиды - это очищенные от механических примесей и большей части воды пастообразные иловые грязи озёр с добавлением многокомпонентных мазей эфтидерма (эфтиллина) в соотношении 3:2. На 1 сеанс эфтипелоидо- терапии требуется от 2 до 5 мл эфтипелоида, после сеанса он легко удаляется влажной бумажной салфеткой (бытовой мусор). Его применение не требует строительства дорогостоящих очистных сооружений. Курс лечения - от 10 до 14 дней, может проводиться как в санаторно-курортных, так и в амбулаторных, и домашних условиях.
Основным компонентом МКМЭ и эфтипелоидов является эфтидерм. Он обладает выраженным противовоспалительным, антиоксидантым, репаративным и асептическим действием. Эфтидерм в течение 5-7 минут проводит через кожу и в течение 1-2 минут через слизистые оболочки биологически активные вещества (БАВ). Он в несколько раз усиливает и пролонгирует их лечебный эффект, до 90 % снижает вероятность возникновения нежелательных явлений, в т.ч. при использовании лечебных грязей, повышает жизнеспособность клеток, особенно важна активация системы фагоцитирующих мононуклеаров [11; 12].
Обсуждаемые вопросы явились предпосылкой для активного освоения и внедрения в практику на базе санаторий «Сунгуль» Челябинской области МКМЭ и эфтипелоидов в сочетании с физиотерапевтическими методами лечения.
Таким образом, в процессе курортного лечения под влиянием любого природного фактора у больных, особенно с заболеваниями воспалительного и дистрофического характера, развиваются сложные процессы, играющие значимую роль в формировании терапевтического эффекта.
С целью оптимизации лечебного процесса, повышения эффективности проводимой терапии, снижения количества осложнений и бальнеологических реакций, а также сокращения сроков лечения и упрощения его, врачи и учёные должны активно разрабатывать и внедрять в практику новые методики и технологии, что позволит эффективнее лечить больных, как в санаторно-курортных условиях, так и в условиях стационара и поликлиники.
Литература
- В.Л. Багирова, Н.Б. Дёмина, И.А. Девяткина и др. // Фарматека. - 1998.- №6. - С. 34-36.
- В.М. Боголюбов, Г.Н. Пономаренко. Общая физиотерапия: учебник. - М.; СПб., 1998.
- С. Бусаров. Фонофорез. - Пловдив, 1968.
- А.Е. Васильев, И.И. Краснюк, С. Равикумар, В.Н. Тохмачи. // Хим.фарм. журн. - 2001. - № 11. - С. 29-42.
- Грецкий В.М. Исследование реологических свойств мазевых основ и мазей.//Труды I Всероссийского съезда фармацевтов.-М.- 1970.-С. 591-599.
- В.М. Грецкий. О влиянии компонентов основ на активность мазей. // Матер, конф.: Биофармацевтические аспекты получения и назначения лекарств. - М,-1971.- С. 104-106.
- В.М. Грецкий. Исследование влияния ряда факторов на фар- макокинетику мазей. // Тр. III Всерос. съезда фармацевтов. - Свердловск.-1975. - С. 105.
- М.В. Даниленко, Н.М. Туркевич. Клиническое применение демиксида. - Киев, 1996.
- A.M. Демецкий, В.Н. Чернов, Л.И. Попова. Введение в медицинскую магнитологию. -Ростов на Дону, 1991.
- В.Е. Илларионов. Техника и методики процедур лазерной терапии. - М., 2001.
- С.Н. Киппер. О некоторых механизмах действия Эфтидерма (обзор) // Материалы межрегиональной научно-практической конференции: «Эфтидерм, эфтиллин и их применение в медицине» -Пермь,- 2004,-С. 3-19.
- С.Н. Киппер. Разработка и изучение фармакологических свойств новых нестероидных противовоспалительных титаносодержащих препаратов транскутанного действия. // Автореф. докт. дисс.-Уфа,-2000,- С.51.
- Н.А. Кодола, М.С. Иванова и др. Клинико-экспериментальное изучение биологических паст на основе полисорба. / Сб. науч. трудов: «Кремнезёмы в медицине и биологии». - Киев. 1993. - С. 127-130.
- Н. Ламбов, Д. Радчев, Е. Минков. // Фармация. - 1987. - Т.37, № 6. - С. 1-8.
- А.Ф. Лещинский, B.C. Улащик. Комплексное использование лекарственных средств и физических лечебных факторов при различной
- патологии. - Киев, 1989.
- П.Г. Мизина, В.А. Быков. Чрескожное введение лекарственных средств: современные аппликационные лекарственные формы: Учебное пособие. - Самара, 2004.
- А.А. Миненков. Низкоэнергетическое лазерное излучение красного, инфракрасного диапазона и его использование в сочетанных методах физиотерапии: Автореф. дисс. д-ра мед. наук. - М., 1989.
- И.М. Могилевич, Н.В. Мейя. Полимерные системы для регулируемого выделения лекарственных веществ (обзор). // Хим. фарм. журн.-1989.-№ 3.- С.361-372.
- Низкоинтенсивная лазерная терапия. / Под ред. С.В. Москвина, В.А. Буйлина. - М., 2000.
- Низкочастотная магнитотерапия. / Под ред. B.C. Улашика. - Минск, 2001.
- Т.А. Панкрушева. Экспериментально-теоретическое обоснование создания мягких лекарственных форм на полимерных основах - производных целлюлозы. // Автореф. док. дисс,- М.- 1995.
- А.П. Парфёнов. Электрофорез лекарственных веществ. - Л., 1973.
- И.М. Перцев, В.Ф. Фесенко, В.М. Доценко. Влияние фармакологических факторов на биологическую доступность лекарств. // Учебно-методич. реком. - Харьков, 1978. - С. 27.
- Н.А. Плата, А.Е. Васильев. Физиологически активные полимеры. - М.- 1985. - С. 45, 74, 85.
- B.C. Улащик. Теория и практика лекарственного электрофореза. - Минск, 1976.
- B.C. Улащик, А.А. Чиркин. Ультразвуковая терапия. - Минск, 1979.
- B.C. Улащик, И.В. Лукомский. Общая физиотерапия. - Минск, 2004.
- B.C. Улащик. Трансдермальная терапевтическая система для чрескожного управляемого введения лекарств в организм. - Пат. №3621., 18.09.2006, Республика Беларусь.
- B.C. Улащик. Трансдермальная физиотерапевтические системы и их лечебное использование. // Физиотерапия, бальнеология, реабилитация. - 2009.- №2. - С. 3-10.
- B.C. Улащик. // Курортные ведомости. - 2008. - №1(46).- С. 15-17.
- С.С. Хмелевская, Ф.А. Жогло, 0.М. Михайлюк и др. // Фармация.- 1989.-Т.38, №1. - С. 14-17.
- J. Fang, Lee W.etal.//Br.J.DermatoL-2004.-Vol.l51,N 1.-P.132-140.
- К. Kyuki, Т. Shibuya, К. Tsurimi, Н. Fujimura, Japan. J. Pharmacol. 1983.- vol.33.- p. 121-132.
- J. Kost, R. Langer. // Topical Drug Bioavailability, Bioeguivalence and Penetration / Edc V.Shah, H.Maibach.-New York, 1993.- P.261-276.
- W. Lee, S. Shen, J.et al. Fang. // J.Pharm.Sci.-2006.-VoL95, №4.- P.929-938.
- The United States Pharmacopeia. The National Formulary (Pharmaceuticael Dosage Form).-USP.-23.-NF.-18.-New York, 1995.
